作者:李新春 来源:药学院 校对:韦微 审核:林晓 发布时间:2023-07-24
近日,药学院“广西高校微纳生物分析与药物筛选重点实验室”在miRNA-21原位荧光成像和化学/基因联合治疗研究中取得重要进展,研究成果以“Framework Nucleic Acid-Based Multifunctional Tumor Theranostic Nanosystem for miRNA Fluorescence Imaging and Chemo/Gene Therapy”为题,发表在美国化学会权威期刊《ACS Applied Materials & Interfaces》(IF:9.49)。论文第一作者为2020级药物分析学专业硕士研究生罗海坤,通讯作者为李新春教授。
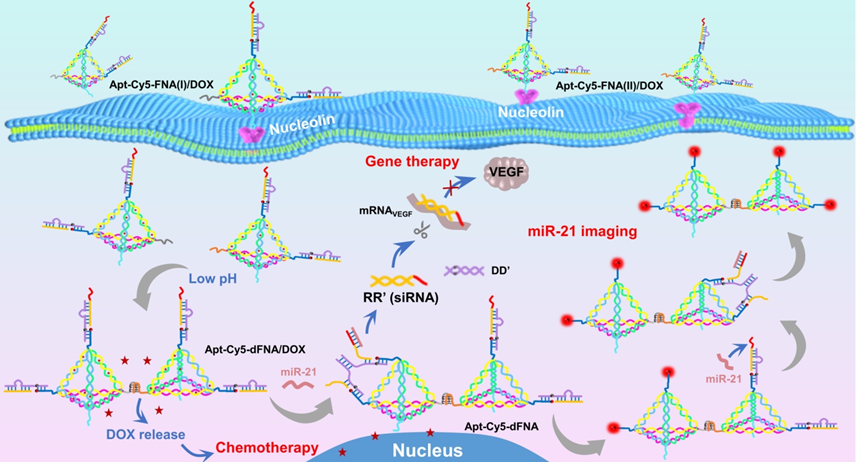
靶向纳米药物是当前精准医学研究的前沿领域之一;其中,肿瘤诊疗一体化技术备受关注,因其可以实现肿瘤的同步诊断和治疗,提高肿瘤诊疗效率。微小RNA(miRNA)是一类非编码RNA,参与基因表达与调控,与肿瘤的发生和转移密切相关,已成为重要的肿瘤标志物;然而,miRNA丰度低,序列高度相似,使得细胞和动物水平的精准检测面临巨大挑战。由小干扰RNA(siRNA)介导的RNA干扰(RNAi)技术可以导致有效的转录后基因沉默,促进mRNA降解,调节蛋白质表达,已发展成为一种极具潜力的基因治疗手段;然而,在外周循环中,siRNA易降解,产生“脱靶”效应,严重削弱了基因治疗作用。另外,传统化疗药物通常组织特异性差、毒副作用大,导致临床治疗效果不佳。原位利用肿瘤细胞中高表达的miRNA作为诊断靶点和siRNA生成刺激物,结合具有靶向识别和有效递送化疗药物(如阿霉素,DOX)的功能纳米材料,有望实现肿瘤分子诊断和化学/基因治疗的一体化。
基于此,研究团队设计了一种基于框架核酸(Framework Nucleic Acid, FNA)的纳米诊疗系统(Apt-Cy5-FNA/DOX),同时实现高效的miRNA荧光成像、化学治疗和RNA干扰。在肿瘤微酸环境下,pH敏感的DNA捕获器(i-motif A和i-motif B)可以触发形成一种FNA二聚体结构(Apt-Cy5-dFNA/DOX);同时,FNA纳米系统可以释放出DOX分子进行化疗。另一方面,在肿瘤细胞中miRNA-21的刺激下,DNA/RNA杂交体通过粘性末端介导的链置换反应,在激活Cy5荧光的同时产生针对RNAi的特异性siRNA。研究亮点包括:(1)核酸适配体介导的靶向药物递送减少DOX的系统毒性;(2)酸驱动FNA二聚体形成可以提供leyu·乐鱼(中国)官方网站的Cy5/BHQ2信号单元和miRNA-21识别位点,提高荧光成像效率和基因干预能力;(3)原位miRNA-21触发的RNAi避免了siRNA在递送过程中的降解和“脱靶”;(4)级联链置换反应诱导释放的miRNA-21可重复利用,从而放大荧光信号并增强RNAi,实现肿瘤(肝细胞癌)的同步诊断和治疗。
该研究得到国家自然科学基金项目资助。
原文链接:https://doi.org/10.1021/acsami.3c01611。